Buchbesprechung zu Graichen, Gisela und Matthias Wemhoff, 2024, Gründerzeit 1200: Wie das Mittelalter unsere Städte erfand. Berlin: Propyläen. 457 Seiten, ISBN 978-3-549-10065-3, Hardcover, 29,00 Euro.
Die Journalistin Gisela Graichen und der Berliner Landesarchäologe Prof. Dr. Matthias Wemhoff haben sich zusammengetan und bringen uns in ihrem Buch die »urbane Revolution« wieder, die sich im Heiligen Römischen Reich um 1200 abspielt. Gemeint sind damit die unzähligen Neugründungen von Städten um 1200. »Die weitaus größte Zahl der Städte in Deutschland entstand im 12. und 13. Jahrhundert.« (Graichen und Wemhoff, 2024, S. 195).
Frankfurt an der Oder, Müncheberg, Straußberg, Potsdam, Brandenburg an der Havel, die mittelalterliche Doppelstadt Berlin-Cölln, Cottbus, Bautzen, Freiburg im Breisgau, Speyer und Worms wurden etwa zwischen 1100 und 1250 gegründet.
Die Neuerscheinung zeigt den enormen Beitrag, den die Archäologie als eigenständige Wissenschaft für die Geschichtswissenschaft leistet. Anhand von Fallbeispielen zu einzelnen Städten legen die Autoren in einem Dutzend Kapiteln frei, wie Deutschlands Städte bereits vor 800 Jahren ihre oft bis heute prägende Gestalt erhalten.
Ich greife für meine Besprechung aus dem Buch die Fallstudie zu Freiburg heraus. Anschließend übertrage ich die Befunde auf die Stadt Frankfurt an der Oder, die in dem Buch nicht explizit behandelt wird, in der ich aber aktuell lebe und arbeite.

Freiburg i. Bsrg. erhält sein Marktrecht und Gründungsprivileg urkundlich belegt im Jahre 1120 von Konrad von Zähringen:
»Kundgetan sei […] dass ich […], an einem Ort, nämlich Freiburg, einen Markt errichtet habe, im Jahr 1120 nach der Menschwerdung des Herrn«
(Graichen und Wemhoff, 2024, S. 196).
Kernanliegen der Gründung durch die Zähringer ist die Schaffung eines Marktes, insbesondere für das Silber aus dem angrenzenden Schwarzwald. Der Marktplatz Freiburg ist dabei wie jeder Stadt des Mittelalters ein durch eine Stadtmauer klar abgegrenzter Raum. Mauern und Tore zum kontrollierten Einlass sind markante Symbole einer mittelalterlichen Stadt. Innerhalb der Stadtmauern folgt der Aufbau von Freiburg dem Idealbild einer mittelalterlichen Stadt: von einer zentralen Hauptstraße entfaltet sich das Straßennetz, im Kern der Stadt befindet sich die Kirche und auf einer etwas bereiteren Straße ist der Marktplatz untergebracht. Bis auf den heutigen Tag erkennt der touristische Besucher diese 800 Jahre alte Grundstruktur.

Freiburg trumpft durch zwei Besonderheiten auf: das Münster und das Bächle. Letzteres bezeichnet ein System von kleinen Kanälen zur Brauchwasserzufuhr bis an fast jede Haustür. Das Münster wird bereits ab dem 12. Jahrhundert als Pfarrkirche errichtet. Es ist das einzige gotische Bauwerk, dass noch im Mittelalter vollständig beendet wird.

Fazit: Die Denker der Aufklärung haben im 18. Jahrhundert die Fake News vom »dunklen Mittelalter« produziert, um ihre Ideen umso heller leuchten zu lassen. Graichen und Wemhoff legen ein gut lesbares Buch vor, dass die Innovationskraft der Städte für Gesellschaft des Mittelalters anschaulich macht. Sie liefern einen weiteren empirischen Beleg dafür, dass am Mythos vom finsteren Mittelalter nicht viel dran ist.
Anwendung für den Geschichtsunterricht
Die Anwendung für den (gymnasialen) Geschichtsunterricht liegt auf der Hand: erkunden Sie mit Ihren Kindern und Schülern ihre eigene Stadt. Welche mittelalterlichen Gebäude, Straßennamen und Strukturen in der Altstadt haben bis heute überdauert?
Als Einstieg bietet sich eine tagesaktuelle Stadtkarte an. In einem zweiten Schritt können Sie diese mit einem älteren Druck vergleichen lassen. Welche Gebäude von »damals« prägen das Stadtbild bis »heute«? Und in einem dritten Schritt können die Schüler die mittelalterliche Stadtgeschichte selbst erkunden. Wer macht das schönste Foto und/oder Selfie vor dem mittelalterlichen Rathaus, in der Schmiedegasse oder der ältesten Kirche der Stadt?
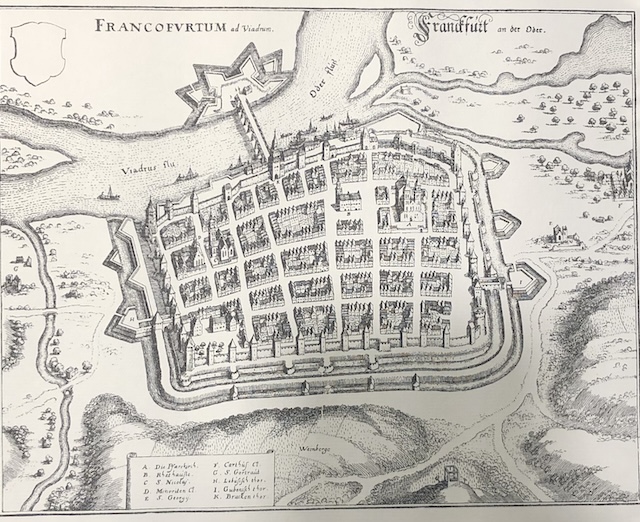
Das funktioniert etwa mit Frankfurt an der Oder ganz hervorragend. Trotz der Zerstörungen durch den Fanatismus des Hitlerregimes prägen die mittelalterlichen Strukturen bis heute das Stadtbild. Reste der Stadtmauer wurden konserviert. Die Friedenskirche ist bis heute erhalten. Und das mittelalterliche Rathaus hat die Stadt für 32 Millionen sanieren lassen. Der Marktplatz ist auch heute Handelsplatz für lokale Nahrungsmittel (sofern wenn man Donnerstags vormittags Zeit zum Einkaufen hat …).